O termo transdução de sinal sempre foi bastante utilizado por físicos para descrever conversão de energia. Há algumas décadas, bioquímicos que estudam como sinais químicos – dentre outros – podem determinar o que ocorre dentro da célula passaram a empregar amplamente o mesmo termo. Pesquisadores brasileiros identificaram em Plasmodium falciparum, espécie causadora da forma mais agressiva de malária em humanos, uma série de genes cuja expressão é modulada pelo hormônio melatonina produzido pelo organismo do hospedeiro. Os resultados foram publicados em artigo de capa na revista Genes & Cancer. Segundo os autores da pesquisa – realizada no âmbito de um Projeto Temático FAPESP –, alguns desses genes representam potenciais alvos para o desenvolvimento de novas drogas antimaláricas.
“Nosso grupo já havia mostrado em estudo anterior que a melatonina, hormônio que regula o ciclo de sono e vigília no organismo hospedeiro, também é capaz de influenciar o ciclo de desenvolvimento do parasita. Temos estudado essa via de sinalização, dentre outras, no parasita, disse Célia Garcia, professora do Instituto de Biociências da Universidade de São Paulo (IB-USP) e pesquisadora responsável pelo Temático.
Em outro trabalho, publicado em 2012 no Journal of Pineal Research, a equipe coordenada por Garcia descobriu que uma cepa de P. falciparum modificada geneticamente para não produzir uma proteína chamada PK7 (proteína quinase 7) era incapaz de regular seu ciclo via sinalização por melatonina.
“Esse dado nos sugeriu que a PK7 tem um papel importante na transdução de sinal por esta via. Passamos, então, a usar essa cepa transgênica em nossas pesquisas para compreender melhor como ocorre a sinalização pela melatonina, ou seja, como ocorre a troca de informação entre o Plasmodium e a célula humana”, disse a pesquisadora.
No trabalho publicado na Genes & Cancer, o grupo investigou como o tratamento com melatonina modifica a expressão dos genes em uma cepa selvagem do parasita em comparação à cepa sem o gene PK7. O objetivo foi descobrir quais genes estão sob controle da melatonina e, em adição, quais deles são influenciados pela PK7.
Os experimentos foram realizados in vitro com hemácias humanas infectadas com o P. falciparum. “Nesse estágio do seu ciclo de vida, o parasita causa todos os sintomas da doença, como febre alta, calafrios e dores no corpo”, contou Garcia.
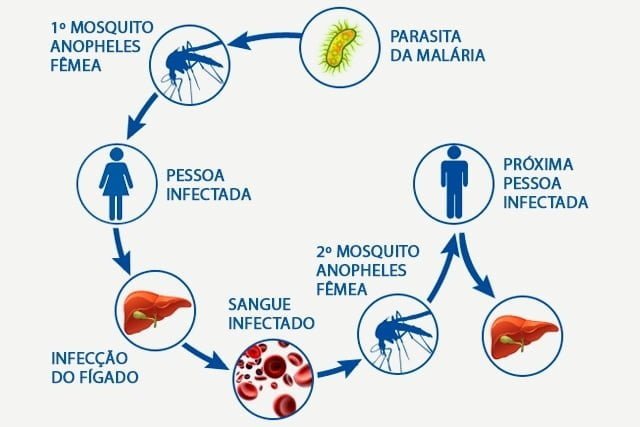
O Plasmodium é um parasita intracelular cujo ciclo de vida ocorre em diversos estágios, cada um deles com morfologia e bioquímica diferentes. É isso que os torna tão complexos e lhes permite interagir com o organismo hospedeiro e sobreviver nos mais diversos ambientes.
Para analisar a expressão gênica na fase de desenvolvimento do parasita conhecida como trofozoíta, foi usada uma técnica conhecida como RNAseq – ou sequenciamento de RNA em larga escala.
“Essa metodologia permite a identificação de pequenas sequências de RNA, que são compiladas em um grande quebra-cabeça para mostrar quais genes estão sendo expressos em determinado estado fisiológico. Para se ter uma ideia da quantidade de dados, cada sequência de RNA analisada tem 100 pares de bases, e são obtidos milhões dessas sequências. Elas são comparadas com o genoma do Plasmodium, que possui cerca de 23 milhões de pares de bases, para identificar a qual gene cada pequena sequência corresponde. Quanto mais sequências de 100 pares de bases são identificadas para um mesmo gene, mais esse gene está sendo expresso”, explicou.
A análise revelou que, nos parasitas selvagens, a melatonina modificou a expressão de 38 genes. Em 31 deles houve aumento e, em sete, queda. Já nos parasitas sem PK7 não foram observadas alterações significativas.
Entre os genes diferencialmente expressos no parasita estavam o SEA-1, que codifica uma proteína expressa no estágio de esquizonte em células vermelhas infectadas.
“Já foi demonstrado que anticorpos contra a proteína SEA-1 diminuem a replicação do parasita por inibir a ruptura dos esquizontes. Também foi observado que parasitas geneticamente modificados para não expressar a SEA-1 apresentam defeitos de replicação”, contou Garcia.
Outro gene alterado pela melatonina foi o CAF1 que, segundo a pesquisadora, é crítico para a regulação de diversos genes durante o estágio de desenvolvimento que ocorre dentro das hemácias (intraeritrocítico).
“Parasitas modificados para não expressar CAF1 sintetizam de forma errônea proteínas envolvidas no processo de saída e invasão de novas células hospedeiras”, disse Garcia.
Bloqueio do ciclo do parasita
A professora do IB-USP também destacou como possíveis alvos terapêuticos genes relacionados às proteínas (E3 ubiquitina ligases) que integram o sistema ubiquitina-proteassoma. O proteassoma é um complexo responsável por limpar a célula de proteínas danificadas e também executa várias outras funções celulares importantes.
O passo seguinte foi repetir o experimento usando no lugar da melatonina uma molécula conhecida como AMPc (monofosfato cíclico de adenosina), um mensageiro secundário importante na via de sinalização da melatonina.
Nesse caso, o teste foi feito em três diferentes estágios do desenvolvimento do parasita, que ocorrem todos dentro das hemácias: anel, trofozoíto e esquizonte. No grupo de parasitas selvagens, a exposição ao AMPc modificou a expressão de 75, 101 e 141 genes respectivamente.
“A ideia de usar o AMPc veio de um trabalho que publicamos em 2005, no qual mostramos que o parasita converte o sinal de melatonina em aumento desse mensageiro intracelular (AMPc) e em ativação da PKA [proteína quinase A]. Além do nosso trabalho, há vários outros que evidenciam a importância do AMPc no processo de invasão das hemácias pelo parasita”, disse Garcia.
Segundo a pesquisadora, os resultados indicam que trofozoítas tratados com AMPc apresentam níveis de expressão aumentados de mRNA da proteína NEK3, que pertence a uma família de genes que participam da replicação do DNA.
“Em esquizonte, o AMPc promoveu maior expressão de transcritos como RPA1, SEA1, NDK e do fator de transcrição myb2. Esse grupo de genes está envolvido com ciclo celular e replicação do DNA. O aumento de expressão desses genes nas formas mais maduras, como trofozoíto e esquizonte, deve justificar porque o ciclo do parasita é acelerado quando tratado com AMPc”, disse Garcia.
Segundo a pesquisadora, vários genes que participam de vias metabólicas também tiveram seus níveis de expressão aumentados e representam potenciais alvos para bloquear o ciclo do parasita na célula vermelha do sangue.
“Cada um desses genes descritos no trabalho está envolvido em atividades metabólicas e fisiológicas. No caso acadêmico, esses resultados podem nos ajudar a entender melhor a biologia básica do parasita: como ele regula seu ciclo de vida e como ele consegue se desenvolver em determinadas circunstâncias. Além disso, alguns desses alvos poderão ser futuramente investigados como auxiliares a drogas que desregulam o ciclo do parasita e facilitam a ação do sistema de defesa humano”, afirmou Garcia.
O artigo Signaling transcript profile of the asexual intraerythrocytic development cycle of Plasmodium falciparum induced by melatonin and cAMP, publicado na Genes & Cancer, pode ser lido em www.impactjournals.com/Genes&Cancer/index.php?pii=118.
Novos alvos contra malária
Após a fase hepática, milhares de merozoítos – outro estágio de desenvolvimento do Plasmodium – são liberados na corrente sanguínea, dando início à fase assexuada do ciclo da malária: invasão dos eritrócitos e ao ciclo intraeritrocítico, com desenvolvimento de estágios de maturação bem definidos: anel, trofozoíto e esquizonte.
Por um mecanismo desconhecido, a célula hospedeira se rompe e os merozoítos são liberados na corrente sanguínea, reinvadem os eritrócitos e recomeçam um novo ciclo. Alguns merozoítos que invadiram os eritrócitos se diferenciam em gametócitos femininos e masculinos, que formam gametas quando ingeridos pelo inseto, dando início à fase sexuada.
“A fecundação desses gametas dá origem a um oocineto móvel, que se aloja no intestino médio do inseto e sofre divisões formando esporozoítos. Os esporozoítos migram para as glândulas salivares do mosquito onde serão liberados durante a alimentação do mosquito”, explicou Garcia.
Para que os esporozoítos se desloquem até as glândulas salivares e possam ser transmitidos a um hospedeiro humano, a cápsula que envolve os oocistos precisa ser rompida.
Em um estudo feito por Garcia, com pesquisadores da Grécia e da Itália, cujos resultados foram publicados na Nature Communications na sexta-feira (16/12), o grupo identificou duas proteínas presentes na cápsula dos oocistos no momento da ruptura.
Os cientistas também observaram que em oocistos sem as duas proteínas, denominadas por eles de ORP1 e ORP2, a ruptura não ocorreu. A proteína ORP1 é encontrada na cápsula dos oocistos desde seu estágio inicial, enquanto a OPR2 deriva do citoplasma da cápsula quando os esporozoítos maduros são formados.
As duas proteínas surgem como novos alvos para interromper a transmissão do parasita por mosquitos.
“O estudo teve origem após nosso grupo identificar que o fator de transcrição PfNFYB, bem estudado em células de mamíferos, é expresso nos diferentes estágios do ciclo intraeritrocítico e se localiza juntamente com a região nuclear nas fases tardias do ciclo, quando poderia exercer a função de fator de transcrição regulando a expressão gênica ou interagindo com outras proteínas”, disse Garcia. Os primeiros resultados foram publicados em 2013 no Journal of Pineal Research.
Com o objetivo de compreender a função do NFYB no ciclo sexual que ocorre no mosquito, os trabalhos com essa proteína foram focados nos estágios de desenvolvimento do parasita no mosquito, denominados: ooquineto, oocisto e esporozoítas. A forma esporozoíta se desenvolve dentro do oocisto, sendo que esporozoítas maduros viajam até a glândula salivar do mosquito e são transmitidos ao hospedeiro no momento da picada do mosquito.
“Em P. berghei, a proteína foi denominada ORP1 (proteína de ruptura do oocisto), pois localiza-se na cápsula do oocisto. O KO (“nocaute”) do gene que codifica a expressão destas proteínas (ORP1) apresenta um bloqueio na ruptura do oocisto. O oocisto é uma forma do parasita cuja parte da membrana vem do epitélio do intestino e parte material sintetizado pelo parasita”, explicou Garcia.
Segundo a pesquisadora, experimentos para verificar a presença dos esporozoítos no oocisto mostraram que parasitas WT (“wild type”) não possuem esporozoítos no dia 12 ou dia 20 (após a infecção), pois esses já migraram para a glândula salivar.
“No entanto os parasitas KO ainda possuem vários esporozoítos no intestino. No estágio sexual a NFYB (ORP) possui uma função não relacionada à ligação de DNA e não se encontra no núcleo, embora possua domínios conservados de NFYB e NFYC”, disse.
Os pesquisadores também caracterizaram uma segunda proteína orp2, que se encontra no citoplasma e migra para a cápsula do oocisto quando o esporozoíto maduro é formado. O KO tanto da ORP1 como da ORP2 leva à falta da ruptura do oocisto.
“A identificação da OPR1 e da ORP2 como proteínas essenciais para a transmissão da malária por mosquitos oferece uma nova compreensão para aspectos da transmissão de esporozoítos na picada do mosquito e sugere que intervenções que tenham como alvo componentes do oocisto possam ser ferramentas eficientes para o bloqueio da transmissão”, destacam no artigo.
“Acreditamos que o entendimento da base da sinalização dos processos celulares dos vários estágios de vida do parasita nos ajudará a identificar novos alvos. O estudo mostra a relevância de compreender a função de proteínas no parasita da malária que mostrou ser distinta nas etapas de vida dentro da hemácia e no mosquito”, disse Garcia.
O artigo Release of Plasmodium sporozoites requires proteins with histone fold dimerization domains (10.1038/NCOMMS13846), publicado na Nature Communications, pode ser lido em www.nature.com/articles/ncomms13846.